知識分享
如何提高「非阻塞性無精症」患者之不孕症治療成功率?
臨床上,2次精液檢查都未觀察到精蟲,診斷為「無精症」(Azoospermia),而無精症的發生率約佔男性人口1%,在男性不孕症人口中,則約佔15%。無精症可分為兩大類:分別是「阻塞性無精症」(Obstructive azoospermia) 與「非阻塞性無精症」(Nonobstructive azoospermia, NOA)。前者是由於運送精蟲的通道受到阻塞,導致精蟲無法排出,好發在輸精管與副睪,患者通常由醫師視情況決定由副睪或睪丸進行手術取精,手術取精的成功率極高;後者則是因為患者的睪丸造精功能異常所造成,治療難度較高,目前最佳的治療策略是以「顯微手術睪丸取精」 (Microdissection testicular sperm extraction, mTESE) 並搭配「單一精蟲顯微注射」(Intracytoplasmic sperm injection, ICSI) 來提高試管嬰兒的成功率[註1]。
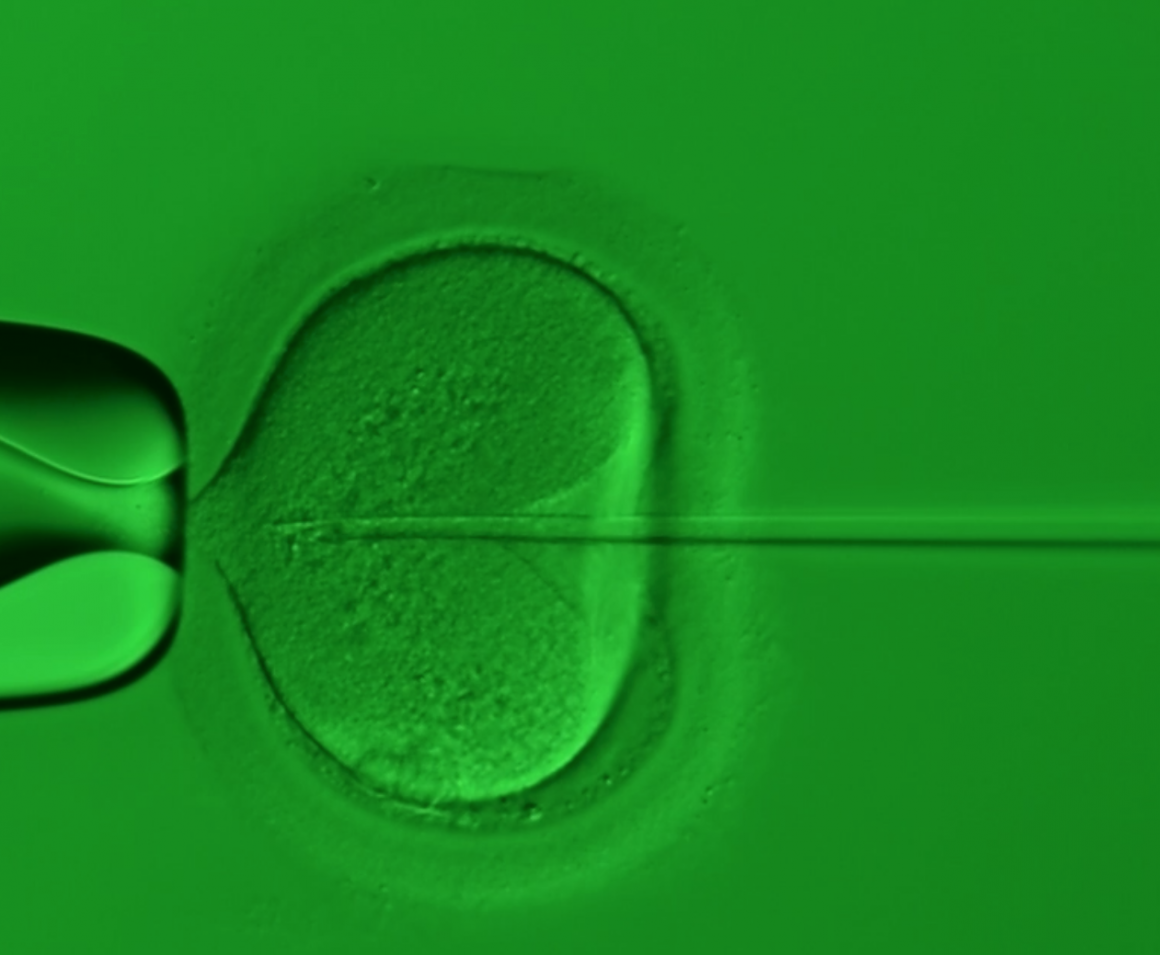
▲單一精蟲顯微注射有助於非阻塞性無精症患者提高受精率
「單一精蟲顯微注射」有助於男性不孕
過去,「單一精蟲顯微注射」已被證實可以顯著改善男性因素所導致的不孕症,有效提高卵子受精率(Fertility rate)與懷孕率(Pregnancy rate)[註2];然而精蟲的挑選極需依賴胚胎師的經驗與判斷,精蟲挑選會根據精蟲本身的活動力(Motility)與形態(Morphology)來進行選擇。在射精取得的精液中,我們通常會以精蟲是否具有活動性作為精蟲是否存活的依據[註3]。先前研究指出於「非」無精症患者使用「單一精蟲顯微注射」時,挑選形態正常且具有活動力的精蟲,即可得較高的卵子受精率與懷孕率。然而,在睪丸手術取精獲得的精蟲並不適用以活動力去判別精蟲是否存活,這是因為成熟精蟲需要在副睪儲存18至24小時後才能取得活動力,因此在睪丸取得的精蟲通常活動力極低,甚至是無活動力,但不代表他們是「死」的精蟲,而是尚未「甦醒」過來而已。

▲於經處理之輸精管組織中收集成熟精細胞。
形態優良且具活動力之精蟲有較好的臨床結果
有別於過去在手術取精後去評估精蟲特徵的研究,在最新發表的論文中,提出應在進行「單一精蟲顯微注射」時對精蟲特性進行觀察與記錄,包含:精蟲是否具有活動力和形態是否異常。形態部分,包含:精蟲的頭部、頸部、尾部以及頂體(Acrosome)。本篇研究中提到,作者在手術取精後,將精蟲培養在37℃環境18至36小時,並經過一系列沉澱、蛋白酶酵素作用、離心…等方式,試圖喚醒精蟲的活動力。精蟲在經過處理後,在這2個時間點(手術取精之後以及「單一精蟲顯微注射」時)所觀察到的活動力會有所差距。因此,該篇論文作者認為在進行「單一精蟲顯微注射」時去記錄精蟲特性是有其必要的。最後根據統計結果,可以得知在進行「單一精蟲顯微注射」時選擇「有」活動力的精蟲相較於「無」活動力的精蟲以及頂體「正常」相較頂體「異常」的精蟲,可以獲得較好的受精率與懷孕率;同時該論文亦指出,並非使用「無」活動力的精蟲或形態「異常」的精蟲會無法成功受孕[註4]。

▲於高倍率顯微鏡下篩選外觀形態良好之精子進行顯微注射。
新鮮手術精蟲受精之胚胎有較佳的活產率
此外,過去曾有進行試管療程的夫婦,由於丈夫手術取精失敗,使原先的試管療程轉為卵子冷凍的案例,這可能造成患者心理壓力與經濟上的負擔。因此,部分學者嘗試對使用冷凍、解凍的精蟲進行「單一精蟲顯微注射」的可行性進行評估,並與使用新鮮手術精蟲進行「顯微注射」的結果進行比較。在研究中,可以觀察到,兩者相較之下,在受精率與懷孕率上並沒有顯著差異,但是在活產率(Live birth rate)部分,使用新鮮手術精蟲相較於冷凍解凍精蟲有較佳的結果;另外,在流產率(Miscarriage rate)部分則可以觀察到使用新鮮手術精蟲相較冷凍解凍精蟲有較低的流產率[註5]。因此,我們可以知道使用新鮮手術精蟲進行「顯微注射」能有較好的臨床結果!由於此篇研究樣本數量偏低,期許未來有更大樣本數與多中心共同研究,去佐證冷凍解凍手術精蟲使用的可行性,並評估對後代的安全性。

了解更多關於 生殖醫學實驗室
參考資料:
- Donoso, P., H. Tournaye, and P. Devroey, Which is the best sperm retrieval technique for non-obstructive azoospermia? A systematic review. Hum Reprod Update, 2007. 13(6): p. 539-49. https://doi.org/10.1093/humupd/dmm029
- Kovac, J.R., et al., Men with a complete absence of normal sperm morphology exhibit high rates of success without assisted reproduction. Asian J Androl, 2017. 19(1): p. 39-42. https://doi.org/10.4103/1008-682X.189211
- Zheng, J., et al., Correction: Decreased Sperm Motility Retarded ICSI Fertilization Rate in Severe Oligozoospermia but Good-Quality Embryo Transfer Had Achieved the Prospective Clinical Outcomes. PLoS One, 2016. 11(10): p. e0165684. https://doi.org/10.1371/journal.pone.0165684
- Aboukhshaba, A., et al., Testicular sperm characteristics in men with nonobstructive azoospermia and their impact on intracytoplasmic sperm injection outcome. Fertil Steril, 2022. 117(3): p. 522-527. https://doi.org/10.1016/j.fertnstert.2021.09.024
- Zhang, Z., et al., ICSI outcomes of fresh or cryopreserved spermatozoa from micro-TESE in patients with nonobstructive azoospermia: CONSORT. Medicine (Baltimore), 2021. 100(12): p. e25021. doi: 10.1097/MD.0000000000025021
其他相關訊息
-
24.May.2024
比較現行主流平台所得之胚胎染色體檢測新見解
-
23.Apr.2024
子宮內肌瘤對於試管療程胚胎著床之影響
-
15.Jan.2024
精子染色質濃縮和精蛋白化可能影響受精後之臨床結果







